Biologie Moléculaire
Immunologie
Généralités sur les vecteurs d'expression et les techniques de purification
Les vecteurs d'expression
Production de protéines : clonage des gènes et production massive par micro-organisme = meilleure solution.
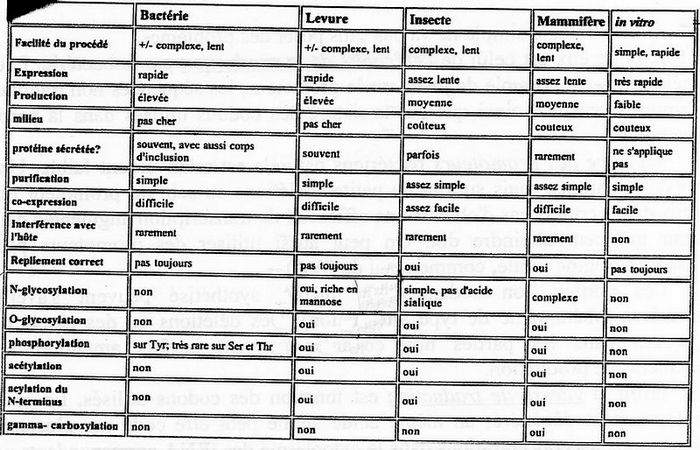
Production par les Bactéries
Stratégie pour produire des protéines humaines : vecteurs d'expression avec comme hôte les bactéries.
Étape 1: construction d'un vecteur d'expression bactérien. Plasmide à reproduction rapide et avec un maintien en très grand nombre dans la bactérie. Ajout d'un promoteur : 3 principaux utilisés : promoteurs des gènes lac-z (β-galactosidase), trp (opéron tryptophane), β-lactamase (gène de résistance à l'ampicilline). Insertion du gène de la protéine à muter dans les trois phases de lectures via des « linkers ».
Étape 2: le vecteur est intégrer dans les bactéries = transformation. Les bactéries les plus performantes sont sélectionnées et cultivées en fermenteur. Alors la protéine est purifiée à partir des surnagents de culture (si sécrétée) ou bien directement à partir des bactéries.
Problème 1: efficacité des la production des bactéries.
- - on peut utiliser des promoteurs plus puissants, notamment des promoteurs d'origine virale comme SV40.
- - modification des séquences non-codantes pour diminuer le phénomène d’inhibition de certains mRNA.
- - vitesse de traduction est fonction des codons utilisés. On modifie le gène d’intérêt avec les codons les plus utilisés par la bactérie pour augmenter la traduction.
- - création de protéine de fusion : protéine désirée et extrémité N terminale de la protéine bactérienne correspondant au promoteur utilisé = augmente la durée de vie de la protéine. Mais il va falloir « couper » la partie bactérienne...
- - utilisation de bactéries mutées qui n'ont plus l'activité protéolytique qui dégrade rapidement la protéine hétérologue.
Protéine très traduite = grosse quantité, mais pas sécrétée donc accumulation dans la bactérie = protéine qui précipite ou cristallise = mort de la bactérie.
Autre problème = récupération de la protéine, généralement pas sécrétée spontanément.. Il faudrait rajouter une courte séquence qui permet à la bactérie de reconnaître que cette protéine doit-être sécrétée. Problème : il faut ensuite « couper » cette séquence une fois la protéine récupérée.
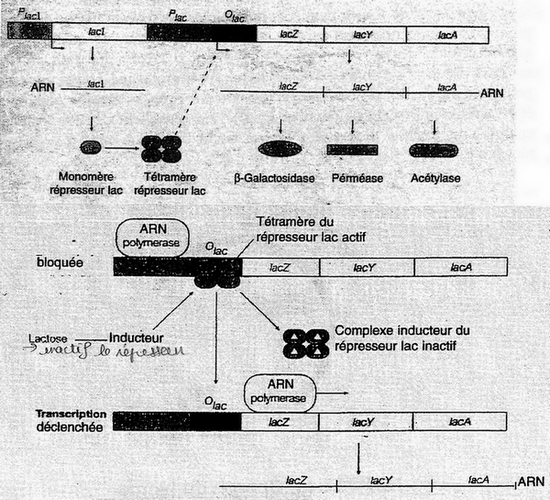
bien connaître cet opéron, sa construction, son organisation et comment il fonctionne.
Les vecteurs pUC: utiliser pour transcrire et exprimer la produit protéine du gène d’intérêt.
Les vecteurs pGEM: promoteur issus des bactériophages T7 et SP6, suivi d'un site MCS.
Avoir notion des cartes plasmidiques, savoir les lires. Avoir notion des His-Tag, bien faire attention aux cadres de lectures...
Souches E. coli utilisées pour l'expression génétiques : BL21 (DE3) et BL21Star (Invitrogen).
Connaître différentes souches E. coli utilisées fréquemment en laboratoires, ainsi que leurs spécificités.
Production par les Cellules Eucaryotes
La stratégie de production de protéines via les bactéries n'est possible que pour les protéines qui n'ont pas besoin de modifications post-traductionnelles complexes. Tout simplement car les bactéries, procaryotes, n'ont pas les enzymes capables de faire ces transformations. Pour les protéines plus complexes il faut donc passer par les cellules eucaryotes, ce qui est une stratégie beaucoup plus compliquée et plus coûteuse.
Il faut construire une vecteur qui s’exprime en un grand nombre de copie chez la cellule hôte. Mais il faut également que le taux de transcription soit maximal. Il faut donc un promoteur fort et une séquence stimulatrice de transcription.
On peut retirer de la séquence des parties qui vont entraîner une instabilité de la protéine dans le milieu. Aussi on peut rajouter des séquences codantes afin de favoriser la production de la protéine d’intérêt. On optimise la séquence du gène à exprimer !
Problème = nature des cellules eucaryotes utilisées.
Cellules eucaryotes en culture = capablent d'effectuer les modifications post-traductionnelles nécessaires à l'activité de la protéine produite. Or parfois ces systèmes de modifications sont spécifiques d'un tissus cellulaire. Gros pb : il est très fréquent de ne pas pouvoir cultiver les cellules eucaryotes différenciées !
En outre il faut que les cellules soient transformées (tout comme les bactéries). On parle ici de « transfection » pour les cellules eucaryotes car souvent effectuée par infection virale.
Problème : lors de la transformations des cellules eucaryotes : elles peuvent perdre des activités enzymatiques nécessaires à la production de la protéines d’intérêt. Aussi : il faut être sur que les cellules modifiées dans lesquelles ont produit ces protéines n'ont aucun risque pour l'Homme. Généralement ces protéines ont pour objectif d'être administrées par injection à l'Homme.
Il existe d'autres systèmes eucaryotes : les plantes, les levures, les animaux transgéniques (comme les lapins pour les anticorps). Par exemple on produit des anticorps chez la chèvre, qui s'expriment dans la glande mammaire. On récupère alors la protéine produite dans le lait de l'animal.
La surexpression passe par la création d'un vecteur d'expression qui contient la séquence de la protéine à produire. La construction d'un tel vecteur est l'occasion d'ajouter une séquence « étiquette » qui va favoriser la récupération et la purification de la protéine.
=> revoir la chromatographie comme procédé de purification des protéines.
- chromatographie d'échange d'ions
- chromatographie d'exclusion ou « gel filtration »
- chromatographie d'affinité