Biologie Cellulaire
Culture Cellulaire : Besoins Nutritifs
Les besoins nutritifs des cellules en culture sont généralement couverts par les milieux de culture qui ont pour but de reproduire aussi fidèlement que possible les conditions d'environnement qui sont ceux de la cellule considérée « in vivo ».
Leur composition variable rendra toujours à maintenir les constantes biologiques et physicochimiques de l'environnement cellulaire.
Elle tiendra également compte des particularités des cellules en cultures exprimées dans les deux tableaux suivants.
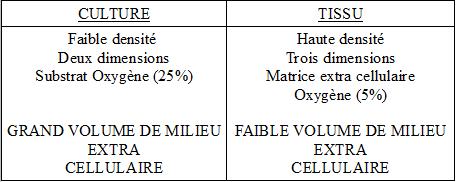
Milieux pour cultures cellulaires
1. Généralités
Alors que plusieurs centaines de milieux ont été décrits dans la littérature pour la croissance des cellules de vertébrés, seuls une douzaine d'entre eux sont encore largement utilisés et commercialisés à ce jour.
Ces milieux, tous des milieux synthétiques, ont connu une évolution remarquable puisque, des milieux de base devant obligatoirement être complémentés par du sérum animal pour assurer la croissance cellulaire, nous en sommes arrivés à toute une génération de milieux définis sans sérum, parmi lesquels des milieux sans protéines ne faisant plus appel à aucun additif d'origine animale.
La première étape précédant de peu les années 1950, se situe avant l'établissement des lignées cellulaires transformées, à un moment où les cellules n'étaient maintenues in vitro que durant un temps très court.
L'un des pionniers de cette époque dans le développement des milieux pour cultures cellulaires fut FISHER (1948) avec le milieu V-605 qui ne présente plus, à l'heure actuelle, qu'un intérêt historique. Le seul milieu datant de cette époque et encore largement utilisé aujourd'hui est le milieu 199 de Morgan et al (1950), originellement développé pour la survie des fibroblastes de cœur d'embryons de poulets ; additionné de sérum, il permet la croissance de nombreux types cellulaires et reste encore un milieu de choix.
La deuxième étape commence au début des années 1950 avec le développement des lignées de cellules transformées, en particulier les cellules HeLa d'origine humaine et les cellules L de souris pour lesquelles la majeure partie des milieux de culture ont été formulés. Parmi les principaux milieux mis au point à cette époque, nous citerons les milieux de Eagle (BME, 1955 - MEM, 1959) figurant encore parmi les plus utilisés.
La troisième étape dès 1970, correspond à un retour à l'emploi et à l'étude de cellules proches de la normalité. Les milieux existant alors avaient été établis essentiellement pour répondre aux besoins des cellules transformées, or celles-ci font preuve d'une telle adaptation nutritionnelle que les milieux qui satisfont à leurs besoins ne permettent pas ou très mal la pousse des cellules dites normales. Pour ces dernières, des milieux spécifiques ont été mis au point parmi lesquels le DME, modification par Dulbecco, du milieu BME.
La quatrième étape correspond au développement des milieux définis ou milieux sans sérum. Commencées dans les années I960, les recherches concernant ce type de milieux connurent un essor exceptionnel à partir des années 1980 lorsque les progrès de la biotechnologie (technique des hybridomes, génie génétique) permirent l'obtention de cellules sécrétrices de protéines. Les exigences liées à la sécrétion de ces protéines ainsi qu'à leur purification, firent de l'obtention des milieux sans sérum un véritable « challenge » pour les chercheurs et les industriels.
Aux milieux définis incluant protéines de transport, hormones, facteurs de croissance (transferrine, insuline, albumine) ont maintenant succédé des milieux sans protéines enrichis le plus souvent en oligo-éléments et composés organométalliques.
2. Composition
A. Maintien des constantes biologiques
1) Constituants minéraux
Sept ions sont indispensables : Na+, K+, Ca2+, Mg2+, les phosphates, les carbonates et Cl-.
Les rapports Na+/K+, Ca2+/Mg2+ constituent deux paramètres essentiels. Ils ont un rôle fondamental dans le maintien des potentiels de membrane et dans les transports transmembranaires (canaux et pompes), sans oublier leur rôle dans le maintien de l'osmolarité.
Ca2+ et Mg2+ ont aussi un rôle fondamental : cofacteurs de nombreuses réactions enzymatiques, ils interviennent dans l'adhésion et l'étalement cellulaire.
Les carbonates et les phosphates, au-delà de leur rôle structural, ont pour fonctions d'assurer le maintien du pH aux environs de la valeur optimale. L'ion Cl- participe au maintien de l'osmolarité.
2) Substances énergétiques
La substance énergétique fondamentale pour les biosynthèses cellulaires en culture est le D-glucose généralement utilisé en concentration de 1 g/1. H peut être remplacé dans certains cas par d'autres glucides : galactose, fructose, mannose, toujours sous forme dextrogyre pour passer la membrane cellulaire.
D'autres substances énergétiques peuvent être fournies : acide pyruvique, non réducteur, acide alpha cétoglutarique. Ces intermédiaires peuvent être synthétisés en culture à partir d'apport exogène de L-glutamine.
3) Acides aminés
Douze acides aminés sont indispensables (en plus de la glutamine) : Les 8 acides aminés essentiels et 4 autres, tyrosine, lysine, arginine, et histidine dont la biosynthèse est impossible in vitro. La glutamine particulièrement instable et dont 98% disparaissent en 120 heures dans certaines cellules est souvent rajoutée extemporanément. Il est à noter que de plus en plus fréquemment, les milieux de culture sont commercialisés avec glutamine.
Ces acides aminés interviennent dans la synthèse des protéines structurelles et fonctionnelles, dans la régulation des synthèses d'ARN et ADN et donc, dans le maintien du cycle cellulaire. Ils sont toujours sous forme lévogyre.
4) Vitamines
Huit vitamines sont indispensables: acide folique, pyridoxal, riboflavine, thiamine, inositol, acide nicotinique, acide panthoténique, choline.
La vitamine C aura un rôle dans le maintien du potentiel d'oxydo-réduction et dans la réaction d'oxydation de la proline en hydroxyproline lors de la synthèse du collagène.
Contre te vieillissement prématuré des cellules in vitro par production de peroxydases due à l'oxygénation importante, on utilise les vitamines K et vitamines E. Certains milieux contiennent
également de la vitamine B12.
5) Métaux
Ils sont présents à l'état de trace, ce sont :
• le fer, le cuivre, le cobalt et autres oligo-éléments
• le sélénium composant de l'enzyme gluthation - peroxydase qui intervient dans la dégradation des peroxydases toxiques métabolisées par les cellules au cours de la culture.
6) Autres constituants
Ce sont des hormones, insuline, hydrocortisone, hormone parathyroïdienne ; des précurseurs des acides nucléiques comme la thymidine, l'uridine, l'adénosine ou encore des substances lipidiques.
7) Eau
C'est le constituant principal des cellules. Sa qualité est essentielle.
B. Maintien des constantes physico-chimiques
1) Le pH
Comme le pH physiologique il doit se situer entre 7,2 et 7,4 (7,35).
Le système tampon le plus fréquemment utilisé est HCO32-, en équilibre avec le CO2. Il est instable, possède un pouvoir tampon faible et nécessite la présence de CO2 à 5% dans l'atmosphère de culture.
Pour contrôler le pH on inclut dans les milieux un indicateur coloré, le rouge de phénol qui vire du violet au jaune entre l'alcalinité et l'acidité (jaune pH 6, orangé pH 7,35, rosé violet pH 8). Le rouge de phénol présente également comme caractéristique.
2) La température
Elle est en général de 37°C, mais peut varier suivant les cellules de 34°C pour la peau à 38°C pour les hépatocytes.
3) L'environnement gazeux
Il comprend un mélange d'azote, d'oxygène, de gaz carbonique et de vapeur d'eau. La plupart des cellules se cultivent en normoxie (21% d'oxygène ambiant) ; pourtant la capacité proliférative des cellules embryonnaire est nettement augmentée lors de leur culture en hypoxie (5%). A l'inverse les hépatocytes préfèrent une légère hyperoxie.
Le CO2 (5%) intervient dans le maintien du phi, dans la biosynthèse des bases puriques et pyrimidiques.
4) L'osmolarité
Elle est très importante. C'est la concentration des sels minéraux qui maintient la pression osmotique de la cellule, la présence de CO2 y participe également. L'osmolarité optimum se situe entre 270 et 320 milliosmole. A noter que la tolérance cellulaire pour l'hypertonie est plus importante que pour l'hypotonie. En cas d'hypertonie la membrane éclate.
Les limites étroites dans lesquelles peut varier la pression osmotique d'une cellule nécessitent qu'aucune évaporation ne se produise pendant la durée de la culture même si cette dernière atteint plusieurs semaines. Afin de répondre à ces exigences, il est important de maintenir dans l'incubateur à CO2 une humidité relative proche de la saturation.
5) La viscosité
Elle est due aux protéines, qui exercent une protection cellulaire indispensable contre les effets mécaniques (turbulences et convection). Une viscosité trop importante gêne la diffusion des produits nutritifs.
Les protéines sont présentes dans le sérum rajouté au milieu de la culture; aussi dans le cas de culture sans sérum, il est indispensable de rajouter des protéines (albumine ou autres).