Biochimie
Les Effecteurs
Les Effecteurs
Les effecteurs sont des molécules qui ont deux propriétés.
• elles se fixent spécifiquement sur l'enzyme,
• elles ont un effet sur la cinétique de la réaction.


On dit que M1 est un activateur car pour une même concentration en Substrat ([S]), la vitesse de réaction (Vi) augmente également.
On dit que M2 est un inhibiteur.
Les effecteurs peuvent être activateurs / inhibiteurs.
Il faut que l'effecteur se fixe sur l'enzyme.

L'EDTA complexe le Mg2+ (et Ca2+) du coup la BetaGal a bcp moins de Mg2+ et la vitesse Vi diminue. Par contre l'EDTA ne se fixe par sur l'enzyme, ce n'est donc pas un effecteur.
1. Les inhibiteurs
Les inhibiteurs irréversibles
Ils sont plutôt des agents dénaturant de l'enzyme.
Les inhibiteurs réversibles
E + I <=> EI
ki = ([E] . [I]) / [EI]
ki = constante d'inhibition; c'est une concentration (mol/L).

Inhibition compétitive
Il existe une compétition entre le Substrat et l'inhibiteur pour la fixation sur le site actif.
Par exemple la BetaGalactosidase, elle a des analogues structuraux comme le thiogalactosidase.
Ex: Succinate Deshydrogénase:

Il existe des analogues structuraux comme: l'oalate, le malonate, le glutarate


- Étude cinétique
- Relation Vi = f ( [S] ; [I] )

- Vm inchangé (ou peu)
- KM augmente
E + S <=> ES --> E + P
E + I <=> EI
Il n'existe jamais de forme EIS!!
[E]T = [ES] + [E] + [EI]
kM = ([E] . [S])/[ES] et ki = ([E] . [I])/[EI]
ce qui donne:
[E] = (kM . [ES])/[S] et [EI] = ([E] . [I])/ki
si on remplace [E]dans la seconde équation, nous avons:
[EI] = ((kM . [ES])/[S]) . ([I]/ki)
d'où:
[S] . [E]T = (kM . [ES])/[S]) + [ES] . [S] + ((kM . [ES])/[S]) . ([I]/ki)
[S] . [E]T = kM . [ES] + [ES] . [S] + kM . [ES]. ([I]/ki)
factorisons:
[S] . [E]T = [ES] . (kM + [S] + kM . ([I]/ki))
[S] . [E]T = [ES] . (kM . (1 + ([I]/ki)) + [S])
ce qui donne:
[ES] = ([S] . [E]T) / (kM . (1 + ([I]/ki)) + [S])
si on multiplie le tout avec k3, cela donne:
k3 . [ES] = k3 . (([S] . [E]T) / (kM . (1 + ([I]/ki)) + [S]))
d'où:
Vi = (Vm . [S]) / kM . (1 + ([I]/ki)) + [S])
=> Vi = (Vm . [S])/ (kMap +[S])
avec kMap = kM . (1 + ([I]/ki))


Déterminons Ki:
kMap = kM . (1 + ([I]/ki)) uniquement en inhibition compétitive!
Facteur d'inhibition = 1 + ([I]/ki)
kMap . ki = kM .([I] + ki)
kMap . ki – kM . ki = kM .[I]
ki = kM – [I] / kMap – kM
D'autre part:
kMap = kM . (1 + ([I]/ki)); or ki = ([E] . [I]) / [EI]
si [I] = ki alors kMap = 2kM
vraie que l'inhibition compétitive!
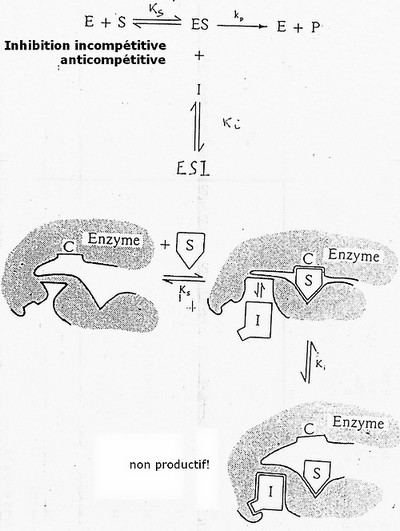
Inhibition non-compétitive

E + I <=> EI
EI + S <=>EIS
ES + I <=> ESI
KM = [E] . [S] / [ES]
ki = [E] . [I] / [EI]
ki' = [ES] . [I] / [ESI]
On doit envisager le cas où il y a deux k inhibiteurs.
=> inhibition compétitive au sens large!
*Cas particulier: ki = ki'

=> inhibition non-compétitive
[E]T = [E] + [ES] + [EI] + [EIS]
Vi = ([S] / (kM + [S])) . (Vm / (1 +([I]/ki)))
où VMap = Vm / (1 + ([i]/ki))
On a donc [I] = ki => VMap = Vm/2
Donc ki est la concentration en inhibiteur quand Vm diminue d'un facteur 2.
Ainsi ki varie en fonction de l'inhibition.

Dans ce type d'inhibition VMap diminue car 1/VMap augmente.
kM reste inchangé (aux erreurs expérimentales près).
On sait que:
VMap = Vm / (1 + ([i]/ki))
si on multiplie le tout avec ki on a:
VMap = (Vm . ki) / (ki + [I])
C'est à dire
VMap . (ki + [I]) = (Vm . ki)
VMap . ki + VMap . [I] = Vm . ki
VMap . [I] = Vm . ki - VMap . ki
VMap . [I] = ki . (Vm - VMap)

ki = (VMap . [I]) / (Vm – Vmap)
on rappelle que ki est une concentration.
Et si ki ki' alors kMap = kM . ((1+([I]/ki)/1+([I]/ki'))
=> inhibition non-compétitive où ki'>ki
ici, avec l'inhibiteur Vm diminue et 1/Vm augmente.
Inhibition anti-compétitive (ou in-compétitive)


[E]T = [E] + [ES] + [ESI] ici [EI] n'existe pas!
Ce qui donne:
Vi = (Vm . [S]) / (KM + [S] . (1+([I]/ki)))
si on divise par (1+([I]/ki)), on a
Vi = ((Vm /(1+([I]/ki))) . [S]) / (KM/(1+ ([I]/ki)) + [S])
cad
Vi = (VMap . [S]) / (KMap + [S])
avec VMap = Vm / (1+([I]/ki))
et KMap = KM / (1+([I]/ki))
Autres types d'inhibitions
- Inhibition par excès de substrat
1er cas: l'invertase
Saccharose + H20 --> Glucose + Fructose.
Réaction catalysée par l'invertase.
Quand la concentration en substrat est élevée, il y a formation d'un dimère de saccharose qui peuvent se lier à l'enzyme et qui jouent alors le rôle de l'inhibiteur!
E + S <=> ES --> E + P
S + S <=> SS
E + SS <=> ESS non productif!
Il y a donc diminution de la concentration en complexe [ES] car E est sous la forme ESS.

2ème cas: l'acétylcholinestérase
hydrolyse les fonctions ester de l'acétylcholine
L'ach se fixe de façon à se situer face au site électrostatique négatif et au site estérasique.
Ici forte affinité donc hydrolyse!
Mais quand on augmente la concentration en ach, certaines molécules se fixent qu'avec le site électrostatique au bon endroit (pb d'encombrement stéarique), alors l'affinité devient plus faible.
La mauvaise position de ces ach en position inverse empêche la fixation de d'autres molécules d'ach ce qui diminue la concentration en ach, donc du complexe [ES] et donc diminue également la vitesse de réaction.

- Inhibition pendant la réaction
E +S <=> ES <=> E + P
mais on a toujours considéré
E + P --> P EP <=> ES
comme négligeable car la concentration en P est négligeable.
Il existe des cas où la concentration en P n'est plus négligeable car P peut influencer la réaction.
Ex: choix du tampon.
2. Les activateurs
Définition
Toute molécule ayant pour une action positive sur la vitesse de la réaction.
Par exemple, le Beta-MercaptoEthanol (βME): il limite la dénaturation en protégeant les ponts disulfures lorsqu'il est en faible concentration
(à forte concentration il les rompt).
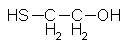
Par exemple, le 1-4, dithiothréiol (DTT): on pouvoir réducteur sur les thiols en fait un réactif très utilisé en biochimie pour empêcher l'oxydation des cystéines dans les protéines.

Plus précisément..

k'3 > k3
On a Vi = k'3 . [EAS] ce qui a pour conséquence d'augmenter Vi.
Les activateurs les plus courants sont des ions métalliques comme le Ca2+, Mg2+, Mn2+ et Co, Zn, Mo qui sont des oligoéléments. Leur rôle est de favoriser une bonne configuration de l'enzyme pour une meilleure la fixation de substrat ou bien de participer directement à la catalyse.

Donc l'activateur n'intervient pas dans la fixation du substrat
5. Annexes.
Version imprimable en pdfDocument supplémentaires
Document supplémentaire 1Exercice