Biochimie
Introduction à la cinétique enzymatique
1. Nature et Rôle
Introduction à la cinétique enzymatique
1. Nature et Rôle
Les enzymes sont de nature protéiques.
Elles sont produites par les cellules vivantes. Ce sont des protéines douées d'activité catalytique. Donc les enzymes possèdent deux sortes de
propriétés:
--> propriétés des protéines
--> propriétés des catalyseurs (99,9% sont des enzymes et 0,1% Ribozymes, dérivés d'acides nucléiques).
Taille: Les plus petites enzymes font environ 12 000g/mol = 12KDa (ex: ribonucléase).
Les plus grosses font environ 1 000KDa or un résidu d'AA fait environ 110g/mol donc les enzymes ont entre 100 et 1 000 AA.
Nombre: On considère qu'il y a environ 2 500 réactions biochimiques catalysées par des enzymes. Or les enzymes diffèrent suivant les espèces donc on arrive à plus de 10^6 réactions.
Rôle: Elles augmentent la vitesse de réaction enzymatique, si la réaction est faisable naturellement.
Ex: CO2 + H2O <=> HCO3+ + H+
Ici , à 25°C, vR = 0,6 mmol/L
Or dans le sang, il y a une enzyme capable de catalyser cette réaction, c'est l'anhydrase carbonique, dans les hématies. Dans ce cas, vR = 50 mol/L/s.
Les facteurs d'augmentation de la vitesse sont de 10^3 à 10^12.
2. L'énergie d'activation
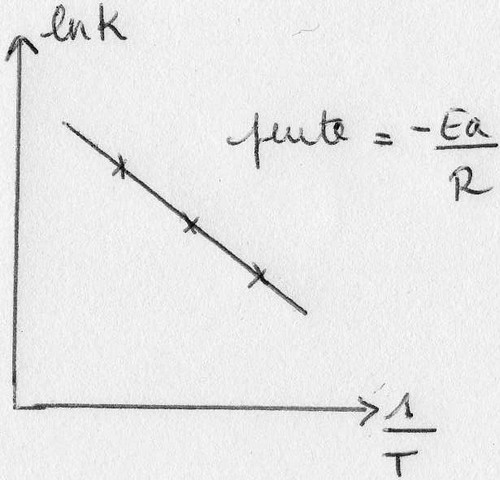
k permet de comparer un milieu à d'autres.
k = constante de vitesse
R = constante des gaz parfait
k0 = constante de vitesse initiale
T = température en Kelvin
Eie a = Energie d'activation
=> Si T°K augmente, on a K qui augmente
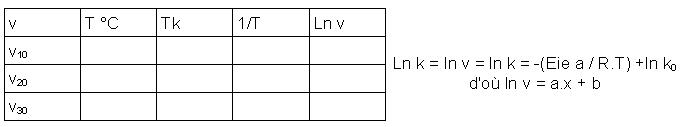
v=k.[S]
ln v = ln k + ln [S] or si dt est court alors [S] est fixe
ln k = ln v – ln [S]
or ln k = -(Ea / R x 1/T) + ln k0
d'où ln v – ln [S] = -(Ea / R x 1/T) + ln k0
ln v = -(Ea / R x 1/T) + ln k0 + ln [S]
or ln K0 + ln [S] = constante
d'où ln v = a.x + b
=> Eie a est facilement calculable grâce à des mesures simples.
Intérêt de Eie a: Théorie du Complexe Activé
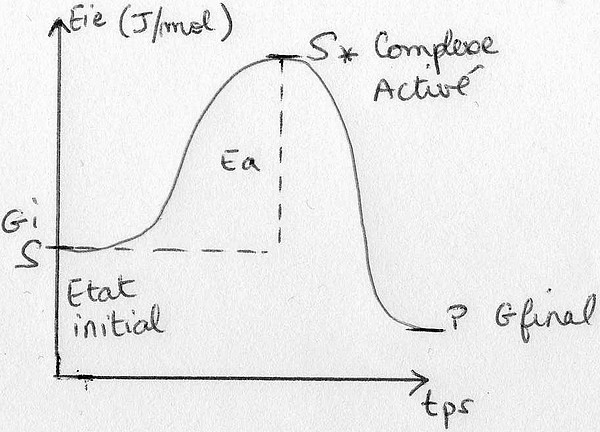
Eie d'activation: Eie qu'il faut fournir au substrat pour qu'il passe au complexe activé, il s'agit d'une étape nécessaire.
Ex: H2O2 --> H2O + 1/2O2
ΔG' < 0 ici Eie a = 72KJ/mol
En présence de platine, Eie a = 48KJ/mol
Catalyseur enzymatique: la catalase
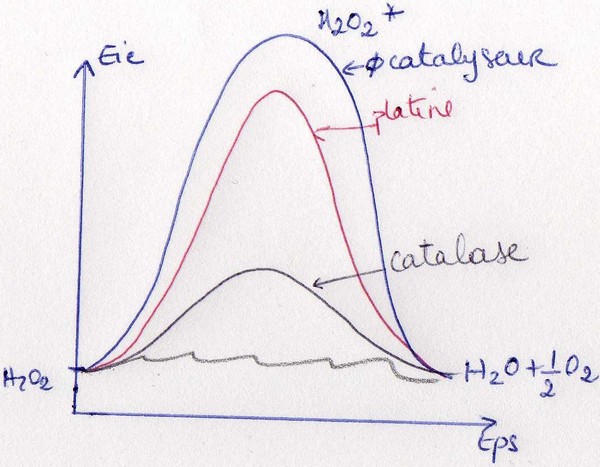
Donc le rôle d'une Enzyme est de diminuer l'énergie d'activation
L'enzyme décompose l'énergie d'un substrat en produit en plusieurs étapes: chacune ayant une faible énergie d'activation.
3. Ordre des réactions
b: ordre partiel de la réaction par rapport à B
a + b: ordre global de la réaction
Ex: nS --> P, on a v = k.[S]^n
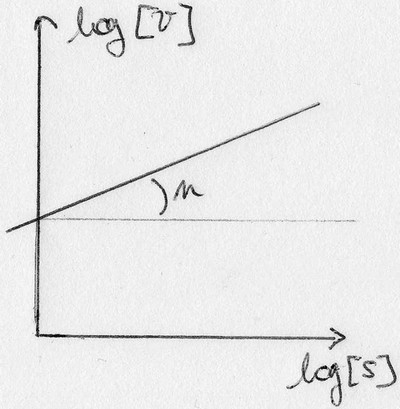
Cas particuliers utiles en enzymologie
=> Ordre 0 par rapport au Substrat
C'est le cas général en enzymologie:
or [S]0 = 1
donc v = k.[E]
=> Ordre 1 par rapport au Substrat
Unité de la constante de vitesse
=> Ordre 1
dt : sec
[A] : mol/L
donc k = sec^-1
=> Ordre 2
dt : sec
[A]2 : (mol/L)2
donc k = (mol/L)^-1 . s^-1
k = L / mol/sec
4. Annexes.
Version imprimable en pdfDocument supplémentaire, en pdf