Biologie Moléculaire et Cellulaire
LES "AGENTS" TRANSMISSIBLES NON CONVENTIONNELS (ATNC)
Cette dénomination s'applique à deux types d'agents transmissibles qui ne sont ni des bactéries, ni des
virus:
-les viroïdes = information génétique sans protéine
-les prions = protéine sans information génétique ?
1. Les Viroïdes
À ce jour, les viroïdes n'ont été observés que dans le règne végétal.
Définition
Un viroïde est un ARN monocaténaire circularisé de taille infime (200 à 400 nucléotides). L'appariement
d'une grande partie des nucléotides donne aux viroïdes l'apparence d'un ARN bicaténaire, compacté en
bâtonnet.
L'ARN ne code aucune protéine. C'est dans le noyau de la cellule infectée que se situe la réplication des
viroïdes, effectuée par l'ARN polymérase cellulaire.
En perturbant la production des ARN-messagers et le fonctionnement des ribosomes, les viroïdes
entraînent d'importants désordres dans le métabolisme cellulaire.
Le premier viroïde, isolé en 1967, cause la maladie des tubercules fusiformes de la pomme de terre. Les
tubercules sont allongés, noueux et leur surface est sillonnée de profondes crevasses, ce qui les rend
impropres à la consommation.
De nombreuses espèces végétales sont infectées par des viroïdes, les dégâts qu'ils causent sont surtout
considérables dans les pays chauds.
Le virus de l'hépatite delta (apparenté aux viroïdes)
Le virus de l'hépatite delta (VHD), spécifique de l'homme, est le seul membre du genre « Deltavirus ».
Le VHD est un virus défectif, car il ne peut se multiplier qu'en présence du virus de l'hépatite B dont il
"emprunte" l'enveloppe. C'est un ARN circulaire - (taille =1,7 kb) compacté en bâtonnet, association d'un
segment ressemblant à celui des viroïdes avec un unique gène codant une protéine : l'antigène delta (Ag
δ).
L'antigène δ dirige la réplication, la morphogenèse et la libération des nouveaux virus.
L'ARN-polymérase cellulaire synthétise l'ARN-m de l'Ag δ et réplique le génome. Le complexe ARN - / Ag
δ quitte le noyau et acquiert l'enveloppe du VHB au niveau du réticulum endoplasmique.
2. Les Prions, Agents Des ESST
Les prions sont les agents transmissibles non conventionnels responsables des encéphalopathies spongiformes subaiguës transmissibles (ESST).
Définition
ESST - l'abréviation résume les points communs de ces maladies:
Encéphalopathie => la cible principale est le cerveau
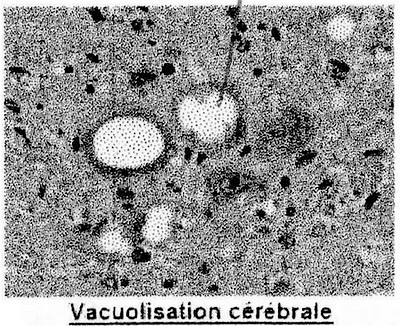
Spongiforme => le cerveau s'altère et prend l'aspect d'une éponge
Subaiguë => l'évolution de la maladie est intermédiaire entre l'état aigu et l'état chronique
Transmissible => d’un individu infecté à un individu sain
Les ESST sont des maladies neurodégénératives caractérisées par une longue période d'incubation
asymptomatique (parfois de plus de 40 ans chez l'homme) suivie par une maladie neurologique
d'évolution subaiguë, létale chez 100 % des sujets en quelques semaines à quelques mois.
Classification des ESST
Les ESST animales.
la tremblante du mouton ou scrapie 1730
l'encéphalopathie transmissible du vison 1947
l'encéphalopathie spongiforme bovine (ESB) 1986
Les ESST humaines
la maladie de Creutzfeldt-Jakob (MCJ) 1920
la maladie de Gertsmann-Strâussler-Sheiriker(GSS) 1936
le kuru 1957
l'insomnie fatale familiale (IFF) 1986
la nouvelle variante de MCJ (nv-MCJ) 1994
Etiologie des ESST
Jusqu'à présent il a été impossible d’isoler les agents responsables des encéphalopathies spongiformes transmissibles, qu'elles soient animales ou humaines.
- a) Propriétés
• ils sont spécifiques d'une espèce
• ils sont filtrables : leur taille est estimée entre 15 à 40 nm (à titre de comparaison, la taille des picornavirus est de 25 nm)
• ils sont titrables (on peut calculer les doses infectieuses)
• ils peuvent "muter" (on peut distinguer des "souches")
• ils ressemblent aux virus lents : infection progressive et incubation très longue (analogie avec le virus de la rougeole et la PESS - panencéphalite sclérosante subaiguë)
- mais n'en ont pas toutes les caractéristiques:
• ils échappent à toute observation en microscopie électronique
• ils ne suscitent ni production d'interféron, ni réaction inflammatoire, ni réponse immunitaire chez leur hôte
• les procédés d'inactivation habituellement efficaces sur des virus - la chaleur, les ultraviolets, les radiations ionisantes et les nucléases - ne parviennent pas à réduire le pouvoir infectieux des cerveaux contaminés, ce qui laisse à penser que "l'agent" responsable est dépourvu d'acide nucléique.
En revanche, l'agent est sensible à certains procédés drastiques qui dégradent les protéines : urée, soude, eau de Javel.
- b) Prusiner : Protéine, PrP et Prion
Le constituant majeur (95 %) de cette fraction est une protéine qui possède une forte tendance à l'agrégation et qui résiste aux protéases - ce qui suggère une structure compacte Prusiner l'appelle PrP
Cette protéine doit être le support unique du pouvoir infectieux. Prusiner appelle cette protéine, le prion (Proteic virion).
La PrP^c: forme normale de la PrP
La PrPc est une glycoprotéine de surface synthétisée par presque toutes les cellules. C'est dans les neurones du SNC qu'on observe les plus hauts niveaux de production.
Le turn-over de la PrPc membranaire est rapide : elle est endocytée et catabolisée par les lysosomes (sa demi-vie n'est que de cinq heures). Sa fonction est encore hypothétique (elle interviendrait dans la transmission synaptique).
La PrP^RES: forme anormale de la PrP
La PrPRES est la forme pathologique de la PrP: on ne la retrouve que dans le cerveau des personnes ou des animaux atteints d'encéphalopathies spongiformes transmissibles.
La seule différence entre PrPc et PrPRES est une différence de conformation de la protéine.
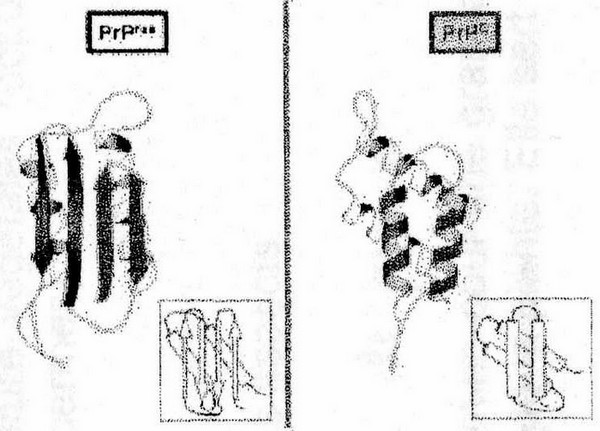
La PrPRES possède davantages de feuillets beta que la PrPc.
La PrPRES possède de ce fait des propriétés physico-chimiques particulières, notamment l'agrégabilité et
la résistance à l'action des protéases.
Les maladies à prion seraient ainsi la conséquence de l'accumulation de la protéine PrPRES.

Cycle de « multiplication » de la PrP infectieuse
- a) Le rôle de la PrP cellulaire
- b) Cycle
• il se réplique d'abord dans le système immunitaire (amygdales plaques de Peyer, ganglions, rate) :les cibles cellulaires sont les lymphocytes B qui vont assurer le transport vers les follicules lymphoïdes secondaires.
• dans les formations lymphoïdes secondaires, les cellules dendritiques folliculaires sont le site de réplication privilégié.
• à partir des fibres nerveuses des organes lymphoïdes, la PrP infectieuse migre vers le système nerveux centrai où la "multiplication" devient quasiment exponentielle.
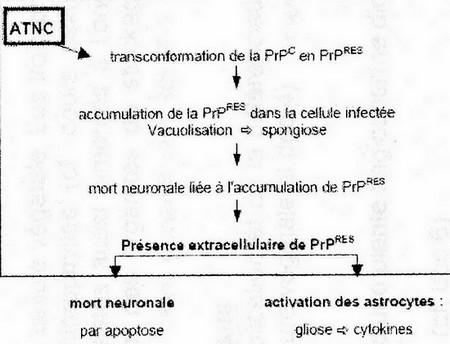
• dans les neurones, la "multiplication" a pour conséquence l'accumulation de la PrP sous forme de PrPRES cette forme anormale dérive de la forme normale PrPc endocytée par la cellule pour son recyclage.
• la PrPRES n'est pas digérée par les protéases cellulaires et s'accumule dans des vacuoles. Quand les vacuoles fusionnent, elles conduisent à la spongiose optiquement visible : le neurone meurt et libère la PrpRES
La PrPRES libérée
• se fixe aux neurones non infectés, ce qui induit leur apoptose
• active les astrocytes, ce qui induit la gliosé et une libération de cytokines capables de léser des neurones.