Biologie Moléculaire et Cellulaire
LA MULTIPLICATION DES VIRUS
Les virus ne peuvent se multiplier qu'à l'intérieur d'une cellule-hôte. Ce sont des parasites
intracellulaires stricts ils utilisent le système producteur d'énergie (ATP), les ARN de transfert et les
ribosomes de la cellule ainsi que toutes les petites molécules nécessaires à leur multiplication.
Après pénétration dans la cellule, le virus apporte seulement l'information génétique nécessaire à la
fabrication des molécules qui le constituent. Il est d'abord répliqué en nouveaux génomes qui sont
ensuite transcrits en ARN-messagers, eux-mêmes traduits en protéines de structure. Ces
macromolécules s'assemblent pour former de nouveaux virions qui sont libérés dans le milieu
extérieur.
Le virus doit détourner à son profit les voies métaboliques de la cellule en diminuant plus ou moins
complètement les synthèses cellulaires : ainsi, certaines protéines virales peuvent inhiber la
transcription et empêcher la traduction des ARN messagers cellulaires.
1. La multiplication des virus dans les laboratoires
Culture sur animaux
Ces cultures ont été les premières utilisées à la suite des travaux de Pasteur sur la rage (culture par
inoculation dans le cerveau du lapin trépané).
Elles n'ont plus que des indications limitées : étude de la transmission des virus (viroses dont on
ignore le réservoir de virus) ; vérification de l'innocuité et de l'efficacité d'un nouveau vaccin , préparation
de vaccins contre la rage dans les pays en voie de développement.
Culture sur oeufs de poules embryonnés
Cette technique est en voie d'abandon dans les laboratoires Elle est toujours utilisée par l'industrie pharmaceutique pour la préparation du vaccin antigrippal: Le vaccin antigrippal est préparé chaque année à partir des souches de virus recommandées par l'OMS. Ces souches sont inoculées dans l'oeuf embryonné, les virus produits sont isolés par ultracentnfugation et inactivés par la bêtapropiolactone.
Cultures cellulaires
En 1949, Enders réalise la première culture d'un virus - le virus poliomyélitique - sur culture cellulaire in vitro. On pratique ces cultures dans des récipients de verre, des boites de Pétri en plastique et, dans l'industrie, sur des billes microporteuses.

Trois types de cultures cellulaires sont utilisées :
-les cultures primaires
-les cultures de cellules diploïdes
-les cultures de cellules en lignée continue
- a) Les cultures primaires
Pour respecter les écosystèmes, les cultures primaires sont de moins en moins utilisées, chaque culture nécessitant la mort d'un animal.
- b) Les cellules diploïdes
- c) Les cellules en lignée continue
De telles cellules "transformées" in vivo donnent naissance à des lignées continues, immortelles:
• les cellules Vero ont été isolées d'une culture primaire de rein de singe vert (Vervet origin)
• les cellules Hela, isolées en 1952 du carcinome du col utérin d'une patiente américaine (Helen Lansing),
• les cellules KB, isolées d'un cancer buccal.
Les cultures cellulaires sont utilisées non seulement dans les laboratoires de recherche mais également dans les laboratoires d'analyse (pour identifier certains virus) et dans l'industrie pharmaceutique (pour la préparation des vaccins, la lignée Vero est de plus en plus utilisée)
2. Aspects cellulaires de la multiplication virale
L'expression du génome viral dans la cellule infectée aboutit à des altérations cellulaires diverses définissant plusieurs types d'interactions virus - cellules:
Le cycle productif
C'est le cycle de multiplication il aboutit à la production de nouveaux virions. Comme il se termine par
la mort de la cellule infectée (à plus ou moins brève échéance) on l'appelle aussi le cycle lytique. La
cellule infectée dans laquelle le virus se multiplie est une cellule permissive. La permissivité d'une
cellule dépend de la présence de cofacteurs cellulaires, capables d'aider l'expression du génome viral
et la fabrication de particules virales.
Dans la cellule infectée
• l'inhibition des synthèses cellulaires,
• la fragmentation de la chromatine par des enzymes virales,
• l'accumulation des macromolécules virales,
conduisent a des lésions observables au microscope optique et qui sont souvent évocatrices du
virus.
·la nappe cellulaire est détruite,
·les cellules sont ballonisées ou au contraire rétractées,
·avec certains virus la fusion des cellules forme des nappes cytoplasmiques contenant de nombreux noyaux : les syncytiums
·après coloration des cellules on peut aussi voir des inclusions dans le noyau ou dans le cytoplasme, selon le site où le virus se multiplie.
Le cycle abortif
Bien qu'ayant pénétré dans la cellule, le génome ne peut pas s'exprimer : les cellules sont des cellules non permissives: elles sont incapables d'assurer entièrement le programme des synthèses virales.
La transformation cellulaire
En pénétrant dans une cellule non permissive, le virus ne peut pas se multiplier. Mais son génome peut
subsister sous la forme d'un épisome : libre ou intégré dans le génome cellulaire.
L'expression de certains gènes viraux ne provoque pas la mort des cellules mais leur donne des
propriétés de croissance et d'immortalité analogues à celles des cellules cancéreuses. Le virus a
transformé la cellule : c'est un virus oncogène.
Les infections virales persistantes
Les infections virales persistantes sont de deux types : latentes ou chroniques.
- a) l'infection latente
Mais, sous l'influence de divers stimuli, le virus "caché" peut entrer dans une phase de réactivation et des particules virales infectieuses sont produites.
• les Herpesvirus sont responsables d'infections virales latentes. Une personne ayant une infection latente n'est contagieuse qu'au cours des périodes de réactivation.
- b) l'infection chronique
• le virus de l'immunodéficience humaine, le VIH, engendre une infection chronique. Le virus est présent, notamment dans le sang, de la primo-infection jusqu'aux stades avancés de la maladie.
• chez 5 % des personnes infectées le virus de l'hépatite B persiste : il est alors responsable d'une infection chronique.
Une personne ayant une infection chronique peut transmettre le virus en permanence.
3. Le cycle de multiplication
Quel que soit le virus, le cycle de multiplication - dans ses grandes lignes - s'effectue en plusieurs
étapes :
Le génome viral doit impérativement se faire "remarquer" par la cellule. Pour cette raison, il code
souvent des protéines non structurales qui ont pour mission de perturber des étapes de la machinerie
cellulaire:
• la réplication de l'ADN cellulaire : inhibition le plus souvent, parfois activation,
• la transcription des ARN-messagers cellulaires, en bloquant leur exportation vers le cytosol,
• la traduction des ARN-messagers cellulaires en empêchant la fixation des ribosomes.
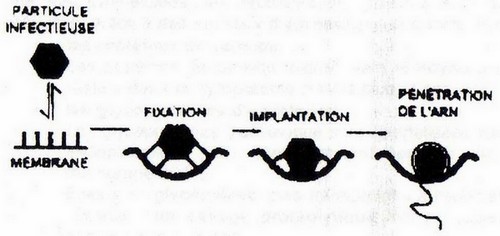
La fixation
C'est l'étape préalable à l'entrée dans la cellule. La fixation des virions nécessite l'interaction:
Les récepteurs utilisés par les virus sont souvent des molécules d'adhésion cellulaires, les CAM (Cell Adhésion Molécule) qui interagissent avec des molécules portées par la membrane plasmique d'autres cellules.
Le spectre d'hôte est défini par la ou les espèces animales et par le ou les tissus que le virus peut
infecter. Le spectre d'hôte dépend de la présence de récepteurs cellulaires.
Quand un virus utilise des récepteurs ubiquitaires, présents sur des cellules d'espèces animales
différentes, le spectre d'hôte est large. Par contre si les récepteurs sont propres à une seule espèce,
le spectre est étroit c'est ce qui explique que des virus sont spécifiques d'une espèce.
• le virus de la rage affecte tous les mammifères
• certains virus se développent à la fois chez un animal, un insecte vecteur et l'homme (les arbovirus)
• certains virus de la grippe peuvent affecter à la fois l'homme, les oiseaux migrateurs le porc et le
cheval
• d'autres sont propres à l'espèce humaine: les virus de la poliomyélite, le virus de la rougeole, le
virus de la rubéole.
Le ligand viral
Quand le virus est nu, c'est une conformation particulière des protéines de la capside. Quand un virus
est enveloppé ce sont les glycoprotéines d'enveloppe.
Le ligand viral des Adenovirus correspond à l'extrémité des fibres (les "antennes" des douze pentons),
il se fixe à des intégrines de la membrane cellulaire.

La pénétation
Selon que le virus est nu ou enveloppé, plusieurs mécanismes sont possibles :
- a) Pénétration directe du génome
• la fixation au récepteur cellulaire déstabilise la capside fermement attachée à la membrane plasmique
• le génome s'en échappe et pénètre directement dans le cytoplasme.
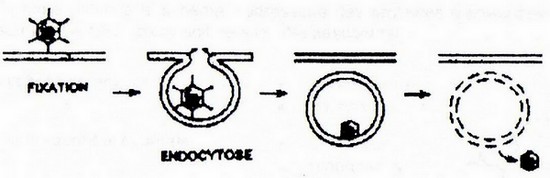
- b) Endocytose à récepteur
Quand un ligand se fixe à son récepteur, il est endocyté. Le virion subit le même traitement : il n'est pas pour autant dans le cytoplasme mais à l'intérieur d'une vésicule dont il doit s'échapper, soit par rupture de l'endosome, soit par fanchissement de la membrane vésiculaire par le génome (cas du virus poliomyélitique).
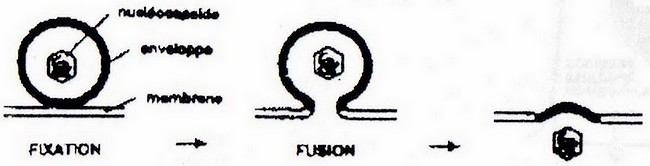
- c) Fusion avec la membrane plasmique
On appelle récepteur la structure cellulaire d'attachement primaire et corécepteur la structure cellulaire d'attachement secondaire nécessaire pour l'étape de fusion. L'enveloppe fusionne avec la membrane cytoplasmique et libère la nucléocapside dans le cytoplasme.
- d) Endocytose à récepteur puis fusion avec la membrane de l'endocyte
La fixation du virus aux récepteurs cellulaires déclenche l'endocytose et le virus se retrouve captif dans la vésicule d'endocytose. L'acidification du contenu de la vésicule d'endocytose révèle les régions hydrophobes des spicules virales qui, en s'implantant dans la membrane vésiculaire, permettent la fusion de l'enveloppe et de la membrane : la nucléocapside est libérée dans le cytoplasme.
La décapsidation
C'est une étape indispensable : la capside doit se désolidariser du génome viral pour que celui-ci puisse
s'exprimer. Cette étape est encore mal connue. On sait seulement que des protéases cellulaires
interviennent dans la décapsidation :
• dans le cas des Picornavirus, la décapsidation se fait en même temps que la pénétration, puisque la
capside reste à l'extérieur de la cellule ou dans la vésicule.
• pour la plupart des virus à ADN, la nucléocapside est prise en charge par une MAP motrice
(Mrcrotubule Associated Protein : kinésine, dynéine), liée aux microtubuies du cytosquelette cellulaire,
qui la transporte vers la membrane nucléaire.
• si le génome a été libéré dans le cytosol, il s'associe à des protéines cellulaires et/ou virales pour
être également pris en charge par les MAP motrices et les microtubules.
Dans ces deux cas, au moins une des protéines associées au génome virai possède un signal de
localisation nucléaire (NLS) qui permet la mobilisation des facteurs cytosoliques responsables de
l'approche finale de la membrane nucléaire et de l'entrée du complexe nucléoprotéique dans le
nucléoplasme au travers d'un pore nucléaire.
• chez certains virus la décapsidation est partielle.
Les Reovirus possèdent une double capside et seule la capside externe est détruite.
Une fois décapsidé, le virus a cessé d'exister en tant que particule organisée : on ne voit plus de virion, il
s'est éclipsé. L'éclipse commence.
Ces 3 étapes, fixation pénétration, et décapsidatton échouent très souvent pour plusieurs raisons:
- fixation sans endocytose ou sans fusion
- endocytose sans libération de la nucléocapside
- destruction du génome viral par des nucléases.
Mais une cellule possède, selon les récepteurs, de 10.000 à 500.000 récepteurs, ce qui permet de
comprendre :
1: que de nombreuses particules virales peuvent se fixer a une cellule,
2: et que, par conséquent, de nombreux génomes sont introduits à l'intérieur de la cellule infectée.
L'éclipse
Malgré son nom, la phase d'éclipsé correspond à la multiplication virale proprement dite. Quel que soit
le virus, la multiplication se fait en deux étapes plus ou moins distinctes :
1 la réplication du génome
2 la transcription des nouveaux génomes en ARN-messagers dont la traduction assure la
formation des protéines nécessaires à la construction de la capside et de l'enveloppe.
Cette multiplication s'accompagne le plus souvent d'une inhibition des fonctions cellulaires.
- a) Les virus à ADN (transcription et réplication dans le noyau)
Le génome est répliqué. Puis, une transcription de ces répliques conduit à la synthèse des protéines tardives: ce sont les protéines de structure, c'est à dire les protéines de capside et d'enveloppe.
- b) Les virus à ARN (transcription et réplication dans le cytoplasme)
- s'il s'agit d'un ARN +, il se comporte comme un ARN-messager et il est immédiatement traduit en protéines. Parmi ces protéines, une réplicase permettra la synthèse de l’ARN complémentaire (ARN - ) qui servira de matrice pour la synthèse des nouveaux génomes. C'est à partir de ces nouveaux génomes que les protéines de structure sont synthétisées.
- s'il s'agit d'un ARN -, il ne peut être traduit directement par les ribosomes et doit donc être préalablement transcrit en ARNmessagers par une transcriptase virale associée au génome.
Le voyage des protéines de structure
Une fois synthétisées, les protéines de structure sont acheminées vers les régions cellulaires adéquates grâce à des signaux d'adressage - une sorte de code postal:
• les protéines de capside
Les protéines de capside migrent vers le noyau pour la plupart des virus à ADN et restent dans le cytoplasme pour la plupart des virus à ARN.
• les glycoprotéines d'enveloppe
Les glycoprotéines d'enveloppe sont synthétisées par les ribosomes liés au réticulum endoplasmique (RE). Elles sont insérées, par une séquence hydrophobe, dans la membrane du RE. Elles sont glycosylées, puis transportées à l'appareil de Golgi ou certaines spicules subissent un clivage protéolytique indispensable à leurs fonctions (virus de la grippe, virus du Sida).
Une vésicule les achemine enfin vers une membrane cellulaire: la vésicule fusionne avec la membrane.
• la protéine de matrice
Va s'apposer sur la face interne de la membrane.
L’assemblage
La phase d'assemblage marque la fin de la période d'éclipsé commencée avec la décapsidation. Les
protéines de capside s'assemblent autour des nouveaux génomes, ou forment une procapside
perméable à l'acide nucléique gênomique, le plus souvent par un processus d'auto-assemblage.
Comme l'indique le schéma, l'adressage des protéines d'enveloppe et de matrice est remarquable soit
vers le pôle apical. soit vers le pôle basolatéral.
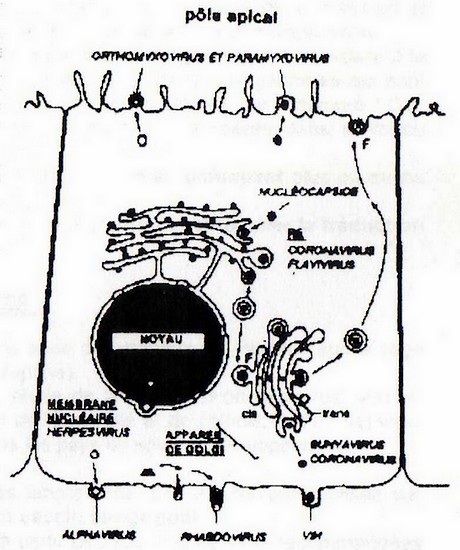
(F = fusion de la membrane vésiculaire, soit avec l'appareil de Golgi, soit avec la membrane plasmique)
Libération
Les virions assemblés quittent la cellule selon trois modalités:
- a) Lyse de la cellule : les virus nus
La libération des virions dépend totalement de la lyse cellulaire.
- b) Le bourgeonnement : les virus enveloppés
- c) Transport : les Herpesvirus
Les Herpesvirus assemblés s'accumulent entre les membranes nucléaires ou dans le réticulum endoplasmique. Enveloppés dans des vésicules ils sont enfin transportés du noyau vers la membrane cytoplasmique. La fusion des membranes vésiculaire et cytoplasmique libère les particules virales à l'extérieur.
Le bourgeonnement n'implique pas la destruction de la cellule. Certains virus enveloppés sont peu cytocides (ainsi le virus de la rage), et la libération des virions se poursuit pendant d'assez longues périodes.