Biologie Moléculaire et Cellulaire
STRUCTURE ET RÔLES DES ANTICORPS
1. Définition d'un anticorps / immunoglobuline.
- Anticorps (Ac):
- Antigène (Ag):
Protéine synthétisée par les lymphocytes B (LB) et les plasmocytes; capable de reconnaître et de se lier spécifiquement à l'Antigène (Ag) ayant stimulé ce lymphocyte.
Toute structure biologique reconnue par un Ac peut-être de nature biochimique, protéïque, glucidique, lipidique ou un acide nucléique.
Si l'Ag est trop petit il peut ne pas être reconnu par l'Ac. Très souvent les Ag peuvent être immunogènes c'est-à-dire capables de produire une réaction immunitaire. Il y a alors synthèse
d'Ac spécifiques.
A Ag étranger correspond un Ac plasmatique qui entraîne une liaison spécifique avec cet Ag.
2. Caractéristiques structurales des Ac.
Un Ac est une « glycoprotéine », c'est à dire que c'est une addition de glucides sur la chaîne de protéines.
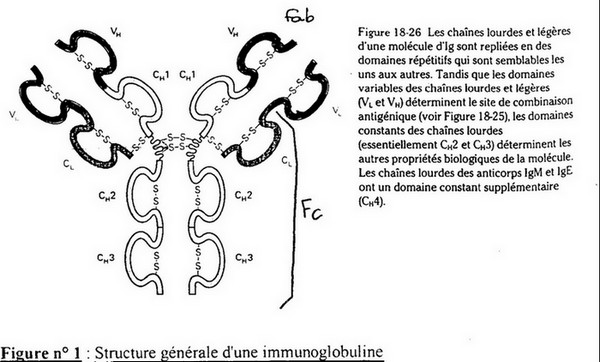
Un Ac est formé de deux chaînes lourdes (H) et deux chaînes légères (L) = soit quatre chaînes peptidiques.
On note l'existence des « ponts disulfures » (S-S) dus à la Cystéine et la Méthionine qui possèdent des AA soufrés ce qui peut entraîner la création de ponts dissulfures (ponts S-S intracaténaires = sur la même chaîne, ou ponts S-S intercaténaires = chaîne différentes).
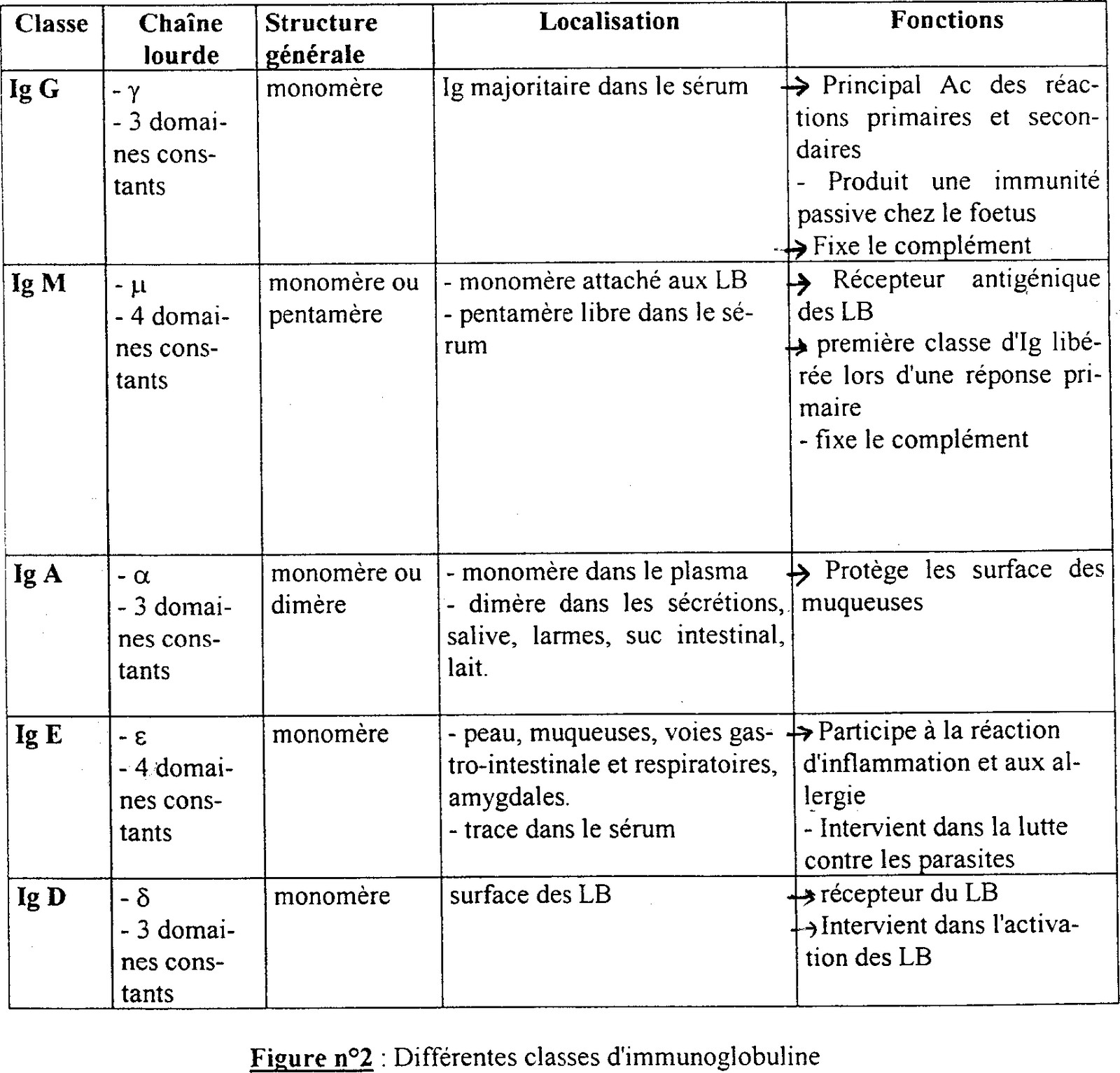
On connaît 5 types de chaînes H différentes: « γ » gamma, « μ » mu, « δ » delta, « α » alpha, « ξ » epsilon. Il y a donc 5 classes d'Ac différentes définies pas ces 5 types de chaînes: IgG, IgM, IgD, ... Idem pour les chaînes L: « κ » kappa, « λ » lambda.
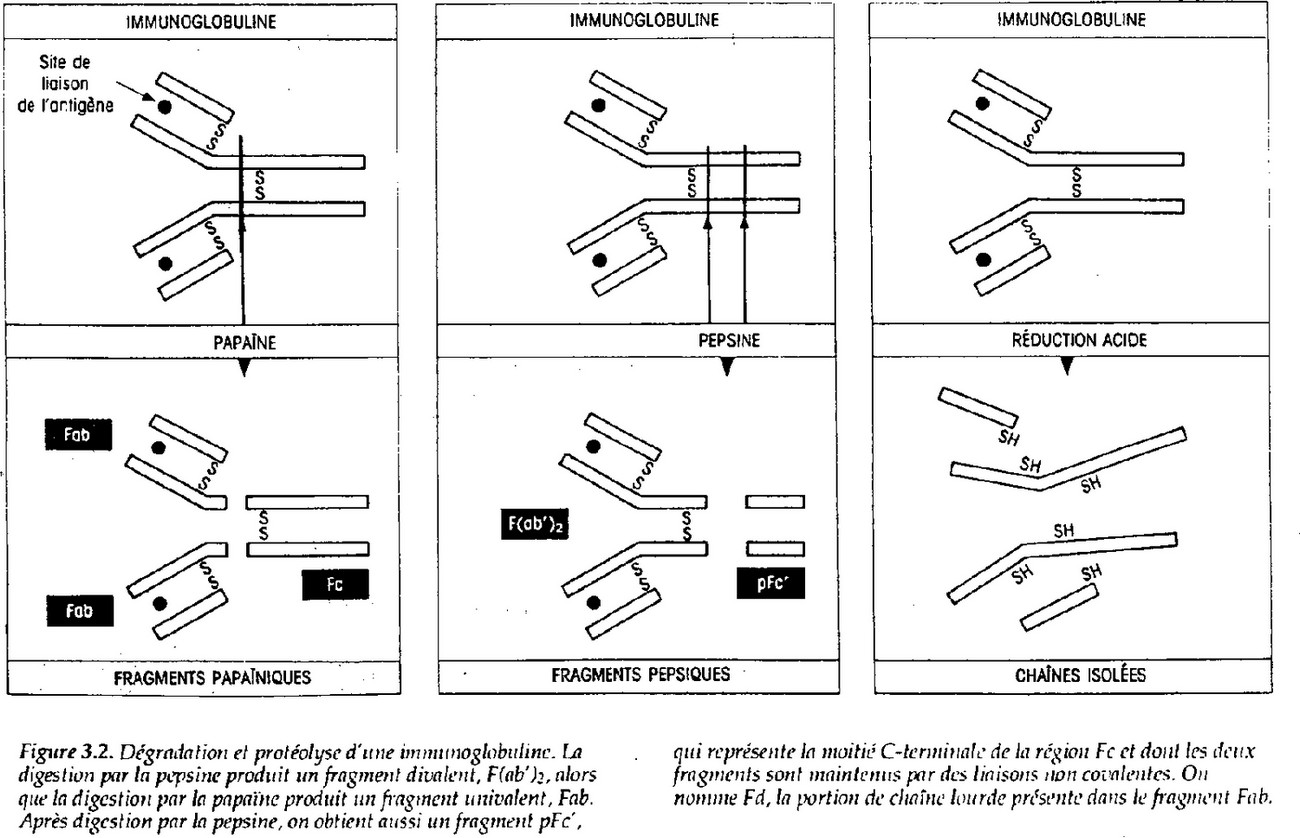
Localisation des sites de fixation à l'Ag.
Cf. polycop.
On conclu qu'il y a bien des sites spécifiques de liaisons à l'Ag, il y en existe deux. Il existe aussi un fragment « Fc » qui n'est pas du tout impliqué dans la reconnaissance de l'Ag. La
réduction d'acide donne des chaînes isolées incapables de reconnaître l'Ag.
Conclusion: le site de reconnaissance est lié à l'interaction des chaînes peptidiques, c'est donc un problème d'interaction dans l'espace.
Structure des Ig.
Séquences en AA:
Il existe une forte hétérogénéité protéique dans le plasma = beaucoup d'Ac différents.
Myélome = protéine monoclonale d'où un seul type d'Ac qui se développent anormalement -> cancer.
Les Ig ont un poids moléculaire variable (mesuré en Dalton): 150KDa, 300KDa, 900KDa, ... Il
y a trois types de poids différents.
- Domaines constant et variable:
- Domaine Hypervariable:
Des techniques permettent de séquencer les AA des IgG. On peut alors comparer les différentes séquences d'AA purifiés.
Pour certaines parties on retrouve souvent les mêmes AA, on appelle cette partie le “domaine constant”. A contrario, pour
d'autres régions il existe une grande différence d'AA, c'est le “domaine variable” (= très forte hétérogénéité).
Les domaines variables sont du côté N-terminal tandis que les domaines constants sont du côté C-terminal.
Les domaines invariables, ou constants, sont aussi appelés “domaines répétitifs”. Il s'agit d'une partie du peptide qui correspond à 110 AA dans lesquels on retrouve toujours un pont disulfure
intracaténaire et qui a une organisation structurale dite “en feuillet ß”.

En conclusion les Ac se ressemblent par les parties constantes et se diversifient par leurs parties variables.
Entre deux domaines répétitifs il y a une organisation en “hélice α”.
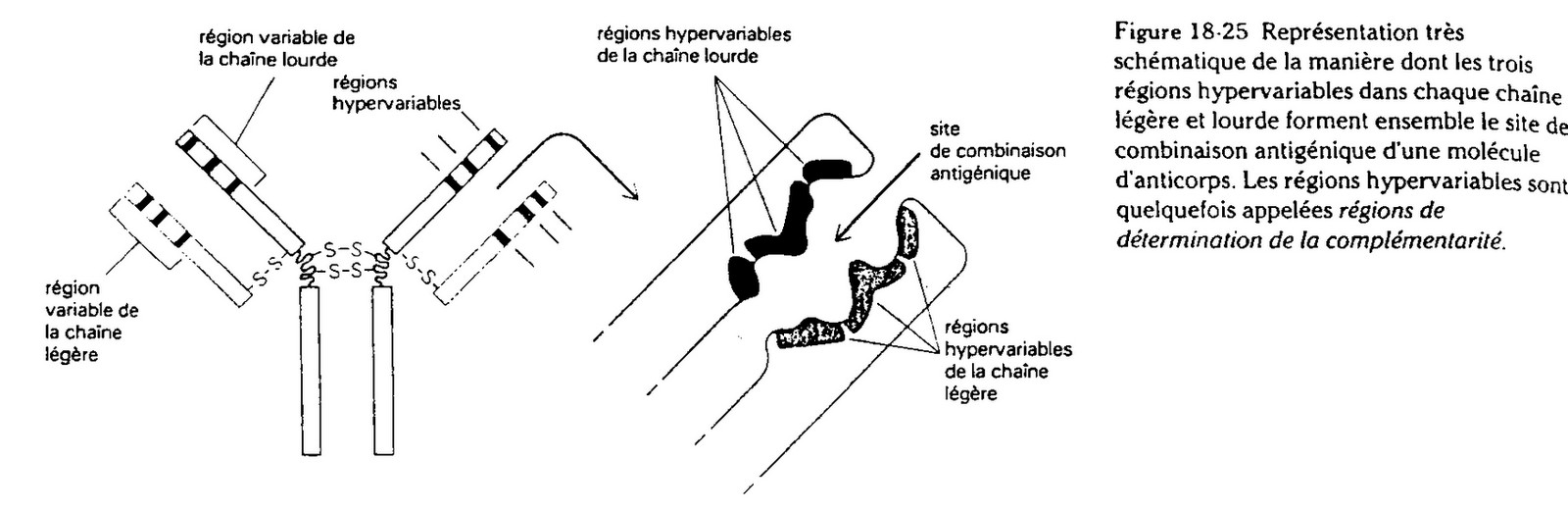
Des études statistiques ont permis de mettre en évidence des régions encore plus vrariable, au
degrès d'hétérogénéité plus important. Ces régions hypervariables font parties des régions variables. Ce sont des AA qui sont responsables de la reconnaissance de l'Ag. Ces zones
hypervariables forment le “Paratope” c'est à dire le site de fixation de liaison avec l'Ag.
Le Paratope reconnait une unique partie de l'Ag, c'est “l'Epitope”.
Classification des immunoglobulines:
Chaîne légère:
-> lambda λ
-> kappa κ
Chaîne lourde:
-> IgG gamma γ (150KDa)
-> IgM mu μ
L'IgM est un pentamère c'est à dire 5 molécules d'Ig réunies pour former l'IgM donc à fort poid moléculaire (900KDa).
-> IgA alpha α
L'IgA est soit un monomère soit un dimère donc d'un poid moléculaire variant (150 ou 300KDa).
-> IgE epsilon ξ (150KDa)
-> IgD delta δ (150KDa).
Les Ig se différencient par leurs chaînes lourdes qui déterminent les différentes classes d'Ig.
Degrès d'hétérogénéité des Ig:
On distingue 3 niveaux d'hétérogénéité qui correspondent à la nature des marqueurs antigéniques des Ig.
Ag = protéine, lipide, glucide, acide nucléique.
Par exemple sur une même protéine il peut y avoir plusieurs épitopes qui seront chacun reconnu par un seul Ac. Donc un Ag peut-être reconnu pas plusieurs Ac différents suivants les marqueurs antigéniques qu'il possède. Or l'Ac est protéine donc il peut avoir différents marqueurs antigéniques et donc Ac = Ag!
Notre organisme ne réagit pas contre le “soi” donc il ne s'attaque pas à nos propres Ac mais
contre ceux d'autres personnes les considérants comme étrangers.
- Isotypie:
- Allotypie:
- Idiotypie:
Propriété d'une protéine de posséder des spécificités antigéniques; on parle de
spécificités isotypiques qui sont communes à une même espèce.
Les déterminismes isotypiques sont des déterminismes antigéniques retrouvés sur les parties constantes CH, CL des Ig.
Porpriété d'une protéine à posséder des spécificités antigéniques, on parle de
spécificités allotypiques qui sont différents chez des individus différents de même espèces. Se sont des variations ponctuelles des structures en AA des Ig qu'on retrouve
sur les parties constantes des chaînes lourdes et légères.
(Chez les vrais jumeaux = même isotypes et même allotypes)
Déterminisme antigénique retrouvé sur un site de reconnaissance de l'Ag et seulement sur les parties variables.
3. Fonctions des Ig.
Première fonction: la reconnaissance.
Elle se caractérise par une interaction spécifique avec l'Ag qui est à l'origine de leur synthèse.
Grâce aux paratopes (AA de l'Ac) qui reconnaissent l'épitope (determinisme antigénique).
L'Ac est capable de reconnaître plusieurs Ag mais un seul avec une excellante affinité. Elle se
caractérise également par la formation de réseaux multimoléculaires. Les Ig sont multivalents
c'est à dire qu'un Ac peut reconnaître au moins 2 Ag.
Ces réseaux sont visibles à l'oeil nu = agglutination. Certains deviennent insolubles =
précipitation. Il s'agit de réaction neutralisant l'Ag.
Deuxième fonction: la fonction effectrice.
Activation du complément:
Le complément défini les protéines du plamsa. Lors de “l'activation” du complément il y a hydrolyse de ces protéines en cascade. Suite à cette activation certaines protéines recouvrent des Ag étrangers, c'est “l'opsonisation”. Ce qui entraîne la phagocytose et la formation de complexes d'attaque membranaire (protéines du complément qui s'inserts dans les membranes formant des pores ce qui iduit des fuites d'éléments cellulaire et donc provoque la lyse cellulaire).
Les Ac, uniquement IgG et IgM, se lient avec l'Ag créer le complexe immun ce qui active le complément.
Interactions avec les récepteurs cellulaires:
Les cellules phagocytaires, notammet les macrophages et les polynucléaires neutrophiles (= Globules blancs), possèdent à leur surface des récepteurs à la partie constante (Fc) des Ig du
type G. C'est à dire que les cellules phagocytaires peuvent fixer des IgG uniquement lorsque l'IgG à former un complexe immun.
La reconnaissance du complexe Ac/Ag favorise la phagocytose de celui-ci.
M: Macrophages
Rfc: Récepteur au Fragment constantes
Ac: Anticoprs
Ag: Antigène
4. Annexes.
Schémas